人工智能在胃癌诊疗和患者预后预测中的应用现状及未来展望
彭东阁, 万子叶, 卢宁
中国癌症杂志
2025, 35 ( 5):
496-504.
DOI: 10.19401/j.cnki.1007-3639.2025.05.008
胃癌是全球范围内高发的恶性肿瘤之一,具有起病隐匿、早期诊断困难、进展期预后不良等特点。传统诊断技术受主观因素影响较大,且在准确率和效率方面存在局限,难以满足精准医学的临床需求。近年来,人工智能(artificial intelligence,AI)技术,尤其是基于深度学习(deep learning,DL)的快速发展,为胃癌的精准诊疗带来了全新的机遇。AI辅助胃镜诊断可显著提升病变检出率及诊断效率,AI驱动的影像组学模型可精准预测肿瘤浸润深度、淋巴结及腹膜转移情况,而AI辅助病理学系统的应用则可以显著提高诊断的准确率和效率。此外,结合多组学数据的AI模型在化疗和靶向治疗反应预测以及个体化预后评估方面亦展现出巨大潜力。然而,AI技术在胃癌领域的临床转化仍面临诸多挑战,包括数据标准化不统一、模型泛化能力不足及算法可解释性较弱等问题。因此,本文系统综述AI技术在胃癌诊断、疗效评估及预后预测方面的最新研究进展,深入探讨当前技术所面临的核心挑战,并展望未来AI在胃癌精准诊疗中的发展趋势,以期推动AI技术的广泛应用和临床转化,最终实现胃癌诊疗的精准化和个体化,改善患者的临床预后。
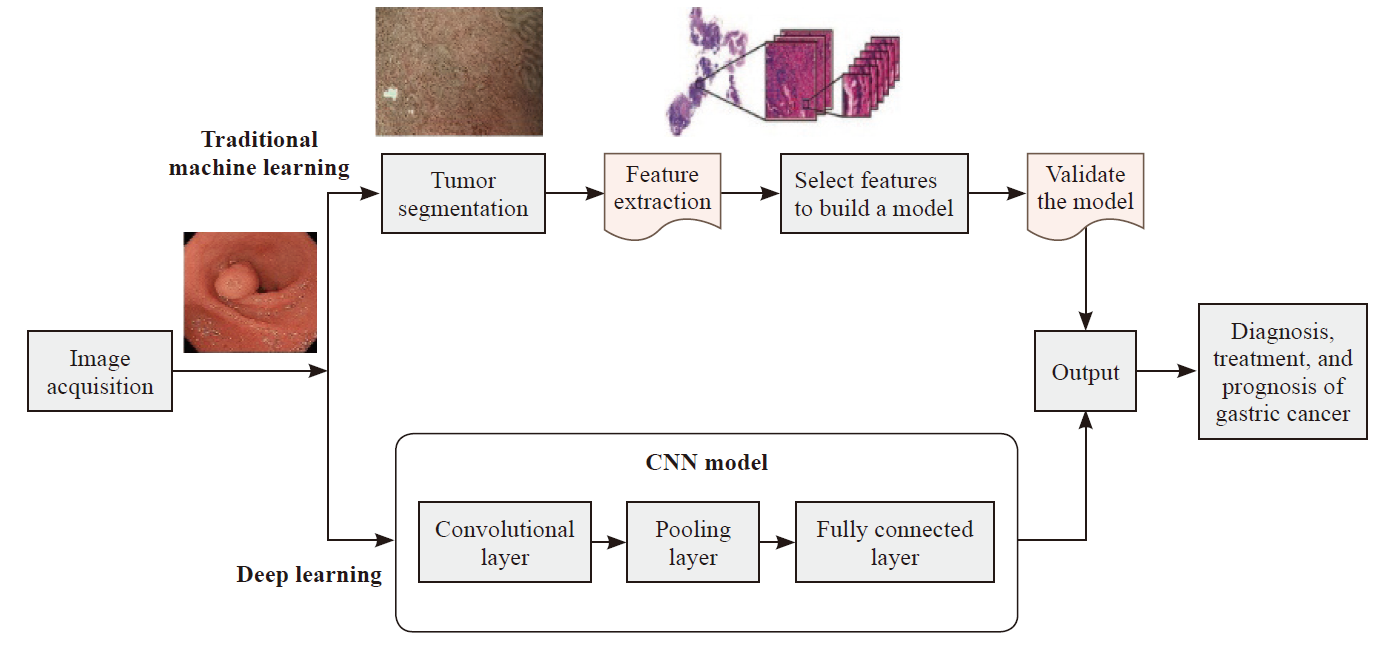
View image in article
图2
内镜图像分析:ML vs DL
正文中引用本图/表的段落
内镜检查包括白光内镜(white-light endoscopy,WLE)、放大内镜、放大内镜联合窄带成像技术(magnifying endoscopy with narrow-band imaging,ME-NBI)和超声内镜等[9]。传统内镜学基于特征工程的ML算法,其流程包括图像采集、肿瘤分割、特征提取及模型训练与验证,用于胃癌诊断。相比之下,DL中的CNN通过多层神经网络进行整个图像序列的端到端输出,自动提取图像中的高级特征,从而识别复杂模式,实现更高效的诊断[10](图2)。Du等[11]利用多模态数据融合(WLE结合弱放大染色内镜)构建的模型,可实时处理视频并进行诊断,显著增强内镜医师与AI的交互,改善患者预后。在辅助诊断测试中,低年资内镜医师在AI的辅助下与专家表现相当(84.50% vs 89.00%,P=0.121),同时大幅缩短诊断时间(30.67 min vs 65.17 min,P<0.05)。该研究反映出AI技术在提高诊断效率和精度方面的巨大潜力。
肿瘤浸润深度是决定胃癌患者接受内镜切除或外科手术的关键标准,但内镜检查对其判断的准确率较低。通过DL可显著提升内镜医师在肿瘤浸润深度诊断中的能力。北京大学肿瘤医院开展的一项多中心、前瞻性、实时竞赛性的比较诊断性研究[19],用ENDOANGEL系统与内镜医师通过比较内镜视图实时答题,在早期胃癌浸润深度和分化状态的预测中,ENDOANGEL的表现与内镜医师相当,专家、高级和初级内镜医师的平均诊断时间分别为2.22、2.53和2.42 h,而ENDOANGEL为1.60 h。AI在提高内镜检查效率的同时,也能为医师节省时间。Gong等[20]基于DL模型训练5 017张内镜图像预测胃癌浸润深度,该模型的胃内病变检出率为95.6%,胃癌浸润深度预测的准确率为89.2%(病变限于黏膜或黏膜下层)。Uema等[21]开发基于AI的超声内镜辅助诊断模型,用于诊断早期胃癌的浸润深度。在诊断性能方面,AI模型的准确率、灵敏度和特异度(74.1%、73.1%和75.0%)与内镜专家的实时诊断相当(75.5%、79.1%和72.2%)。综上所述,AI在胃癌浸润深度评估中具有显著的临床应用前景,尤其在提高诊断准确率和工作效率方面展现出特有优势。
多组学数据融合分析是未来肿瘤诊疗的重要趋势。北京大学肿瘤医院沈琳教授团队收集了多中心429例HER2阳性胃癌患者的数据,包括临床信息、影像与病理学图像及其结构化报告,基于此数据集开发AI驱动的精准预测模型MuMo,该模型在抗HER2靶向治疗及联合免疫治疗反应预测中表现优异(AUC为0.821和0.914),并有效地将患者分为高风险组和低风险组,从而提供更有针对性的治疗建议[46]。尽管研究展示出多组学数据与AI结合在复杂疾病中的应用前景,但肿瘤的异质性和AI算法存在的偏差,可能会影响预测的准确率。需要通过持续学习和引入更多的数据类型来进一步完善、优化模型。
GAN: Generative adversarial network; RFS: Recurrence-free survival. ... Endoscopic three-categorical diagnosis of Helicobacter pylori infection using linked color imaging and deep learning: a single-center prospective study (with video) 1 2020 ... WHO将Hp定义为一级致癌物,Hp感染在胃癌的发生、发展中发挥重要作用[15].Yang等[16]开发的胃镜图像AI辅助综合分析系统,收集了516例患者的6 270张WLE图像,带入14种CNN模型进行训练,EfficientNetB7模型对区分Hp与非Hp感染的预测准确率达83.33%,受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)为0.909 6.随后,Nakashima等[17]进行了单中心前瞻性队列研究,分别对AI辅助胃镜诊断有无Hp感染及除菌是否成功进行研究,结果发现AI辅助WLE诊断Hp感染的灵敏度和特异度分别为86.7%和86.7%,AUC为0.956.另外,基于图像增强胃镜的AI诊断Hp不同感染状态的准确率优于基于WLE的AI,且与有经验的内镜医师相当.这些研究结果突显出AI在提高胃癌早期诊断效率和准确率方面的潜力,但仍需进一步优化算法,提升泛化能力,以应对不同临床环境下的挑战. ... Convolutional neural network for differentiating gastric cancer from gastritis using magnified endoscopy with narrow band imaging 1 2020 ... 早期胃癌的病变不明显,有时与胃炎难以区分.Horiuchi等[18]使用ME-NBI获取的1 492张早期胃癌图片和1 078张胃炎图片进行基于CNN模型的训练,在由151张早期胃癌图片和107张胃炎图片组成的独立测试集中取得0.853的准确率,其灵敏度、特异度、阳性预测值和阴性预测值分别为0.954、0.710、0.823和0.917,平均阅片速度为51.83张/s.Yang等[16]在胃内良/恶性病变的二分类研究中,EfficientNetB7模型的AUC为0.994 3,对早期胃癌预测的准确率为91.76%,而对良性病变预测的准确率为99.52%.然而,这些模型在应对复杂病变和较为细微的内镜下特征时,仍有进一步优化的空间. ... Deep learning system compared with expert endoscopists in predicting early gastric cancer and its invasion depth and differentiation status (with videos) 2 2022 ... 肿瘤浸润深度是决定胃癌患者接受内镜切除或外科手术的关键标准,但内镜检查对其判断的准确率较低.通过DL可显著提升内镜医师在肿瘤浸润深度诊断中的能力.北京大学肿瘤医院开展的一项多中心、前瞻性、实时竞赛性的比较诊断性研究[19],用ENDOANGEL系统与内镜医师通过比较内镜视图实时答题,在早期胃癌浸润深度和分化状态的预测中,ENDOANGEL的表现与内镜医师相当,专家、高级和初级内镜医师的平均诊断时间分别为2.22、2.53和2.42 h,而ENDOANGEL为1.60 h.AI在提高内镜检查效率的同时,也能为医师节省时间.Gong等[20]基于DL模型训练5 017张内镜图像预测胃癌浸润深度,该模型的胃内病变检出率为95.6%,胃癌浸润深度预测的准确率为89.2%(病变限于黏膜或黏膜下层).Uema等[21]开发基于AI的超声内镜辅助诊断模型,用于诊断早期胃癌的浸润深度.在诊断性能方面,AI模型的准确率、灵敏度和特异度(74.1%、73.1%和75.0%)与内镜专家的实时诊断相当(75.5%、79.1%和72.2%).综上所述,AI在胃癌浸润深度评估中具有显著的临床应用前景,尤其在提高诊断准确率和工作效率方面展现出特有优势. ...
GAN: Generative adversarial network; RFS: Recurrence-free survival. ... Deep learning-based clinical decision support system for gastric neoplasms in real-time endoscopy: development and validation study 1 2023 ... 肿瘤浸润深度是决定胃癌患者接受内镜切除或外科手术的关键标准,但内镜检查对其判断的准确率较低.通过DL可显著提升内镜医师在肿瘤浸润深度诊断中的能力.北京大学肿瘤医院开展的一项多中心、前瞻性、实时竞赛性的比较诊断性研究[19],用ENDOANGEL系统与内镜医师通过比较内镜视图实时答题,在早期胃癌浸润深度和分化状态的预测中,ENDOANGEL的表现与内镜医师相当,专家、高级和初级内镜医师的平均诊断时间分别为2.22、2.53和2.42 h,而ENDOANGEL为1.60 h.AI在提高内镜检查效率的同时,也能为医师节省时间.Gong等[20]基于DL模型训练5 017张内镜图像预测胃癌浸润深度,该模型的胃内病变检出率为95.6%,胃癌浸润深度预测的准确率为89.2%(病变限于黏膜或黏膜下层).Uema等[21]开发基于AI的超声内镜辅助诊断模型,用于诊断早期胃癌的浸润深度.在诊断性能方面,AI模型的准确率、灵敏度和特异度(74.1%、73.1%和75.0%)与内镜专家的实时诊断相当(75.5%、79.1%和72.2%).综上所述,AI在胃癌浸润深度评估中具有显著的临床应用前景,尤其在提高诊断准确率和工作效率方面展现出特有优势. ... A novel artificial intelligence-based endoscopic ultrasonography diagnostic system for diagnosing the invasion depth of early gastric cancer 1 2024 ... 肿瘤浸润深度是决定胃癌患者接受内镜切除或外科手术的关键标准,但内镜检查对其判断的准确率较低.通过DL可显著提升内镜医师在肿瘤浸润深度诊断中的能力.北京大学肿瘤医院开展的一项多中心、前瞻性、实时竞赛性的比较诊断性研究[19],用ENDOANGEL系统与内镜医师通过比较内镜视图实时答题,在早期胃癌浸润深度和分化状态的预测中,ENDOANGEL的表现与内镜医师相当,专家、高级和初级内镜医师的平均诊断时间分别为2.22、2.53和2.42 h,而ENDOANGEL为1.60 h.AI在提高内镜检查效率的同时,也能为医师节省时间.Gong等[20]基于DL模型训练5 017张内镜图像预测胃癌浸润深度,该模型的胃内病变检出率为95.6%,胃癌浸润深度预测的准确率为89.2%(病变限于黏膜或黏膜下层).Uema等[21]开发基于AI的超声内镜辅助诊断模型,用于诊断早期胃癌的浸润深度.在诊断性能方面,AI模型的准确率、灵敏度和特异度(74.1%、73.1%和75.0%)与内镜专家的实时诊断相当(75.5%、79.1%和72.2%).综上所述,AI在胃癌浸润深度评估中具有显著的临床应用前景,尤其在提高诊断准确率和工作效率方面展现出特有优势. ... Performance measures for upper gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) quality improvement initiative 1 2016 ... AI通过执行多项任务来确保消化内镜检查期间的质量控制,如监测盲区、记录检查时间、自动识别解剖结构和评估黏膜清洁度等.充足的检查时间是提高内镜质量的方法之一,对于接受内镜检查的患者,推荐将AI辅助内镜检查时间作为质量控制工具[7].2016年,欧洲胃肠内镜学会(European Society of Gastrointestinal Endoscopy,ESGE)提出首次诊断性胃镜检查时间至少7 min[22].在一项收集49个胃镜视频作为模型训练和验证数据集的研究[23]中,AI辅助系统在93.7%的视频中正确预测开始时间,在97.1%的视频中正确预测结束时间,且AI辅助组胃镜程序的平均检查时间显著长于对照组(5.03 min vs 4.24 min,P<0.001).完整观察整个胃是保证诊断性胃镜质量的前提[7],ESGE提出胃镜检查至少要获得10张胃图像[23].在一项随机对照研究[23]中,AI辅助系统能以90.4%的准确率监测盲点,它和对照组分别分析153和150例患者,AI辅助组的盲点率低于对照组(5.86% vs 22.46%,P<0.001).AI在提高内镜检查质量和减少盲区方面具有显著优势,能够为患者提供更加全面和精确的检查. ... Real-time multi-label upper gastrointestinal anatomy recognition from gastroscope videos 3 2022 ... AI通过执行多项任务来确保消化内镜检查期间的质量控制,如监测盲区、记录检查时间、自动识别解剖结构和评估黏膜清洁度等.充足的检查时间是提高内镜质量的方法之一,对于接受内镜检查的患者,推荐将AI辅助内镜检查时间作为质量控制工具[7].2016年,欧洲胃肠内镜学会(European Society of Gastrointestinal Endoscopy,ESGE)提出首次诊断性胃镜检查时间至少7 min[22].在一项收集49个胃镜视频作为模型训练和验证数据集的研究[23]中,AI辅助系统在93.7%的视频中正确预测开始时间,在97.1%的视频中正确预测结束时间,且AI辅助组胃镜程序的平均检查时间显著长于对照组(5.03 min vs 4.24 min,P<0.001).完整观察整个胃是保证诊断性胃镜质量的前提[7],ESGE提出胃镜检查至少要获得10张胃图像[23].在一项随机对照研究[23]中,AI辅助系统能以90.4%的准确率监测盲点,它和对照组分别分析153和150例患者,AI辅助组的盲点率低于对照组(5.86% vs 22.46%,P<0.001).AI在提高内镜检查质量和减少盲区方面具有显著优势,能够为患者提供更加全面和精确的检查. ...
GAN: Generative adversarial network; RFS: Recurrence-free survival. ... Cancer mutations converge on a collection of protein assemblies to predict resistance to replication stress 1 2024 ... 不同肿瘤的药物敏感性和耐药性存在显著差异,深入了解其机制对优化治疗至关重要.Zhao等[43]探讨了如何利用DL算法预测肿瘤何时会对化疗产生耐药性.Wang等[44]基于8个溶酶体相关基因利用转录组数据及单细胞测序数据,构建了AI辅助胃癌疗效预测模型,该模型能够准确预测胃癌患者化疗或免疫治疗效果(AUC为0.92),从而改善患者的预后.Gao等[45]提出一种增量监督对比学习模型iSCLM,整合预处理CT和H-E染色活检图像,能准确预测化疗效果并优化新辅助化疗方案(AUC:0.846~0.876).根据模型预测结果,接受iSCLM建议组与拒绝iSCLM建议组的5年生存率分别为48.6%和35.6%(P=0.005). ... Establishment of a novel lysosomal signature for the diagnosis of gastric cancer with in-vitro and in-situ validation 1 2023 ... 不同肿瘤的药物敏感性和耐药性存在显著差异,深入了解其机制对优化治疗至关重要.Zhao等[43]探讨了如何利用DL算法预测肿瘤何时会对化疗产生耐药性.Wang等[44]基于8个溶酶体相关基因利用转录组数据及单细胞测序数据,构建了AI辅助胃癌疗效预测模型,该模型能够准确预测胃癌患者化疗或免疫治疗效果(AUC为0.92),从而改善患者的预后.Gao等[45]提出一种增量监督对比学习模型iSCLM,整合预处理CT和H-E染色活检图像,能准确预测化疗效果并优化新辅助化疗方案(AUC:0.846~0.876).根据模型预测结果,接受iSCLM建议组与拒绝iSCLM建议组的5年生存率分别为48.6%和35.6%(P=0.005). ... Interpretable multi-modal artificial intelligence model for predicting gastric cancer response to neoadjuvant chemotherapy 1 2024 ... 不同肿瘤的药物敏感性和耐药性存在显著差异,深入了解其机制对优化治疗至关重要.Zhao等[43]探讨了如何利用DL算法预测肿瘤何时会对化疗产生耐药性.Wang等[44]基于8个溶酶体相关基因利用转录组数据及单细胞测序数据,构建了AI辅助胃癌疗效预测模型,该模型能够准确预测胃癌患者化疗或免疫治疗效果(AUC为0.92),从而改善患者的预后.Gao等[45]提出一种增量监督对比学习模型iSCLM,整合预处理CT和H-E染色活检图像,能准确预测化疗效果并优化新辅助化疗方案(AUC:0.846~0.876).根据模型预测结果,接受iSCLM建议组与拒绝iSCLM建议组的5年生存率分别为48.6%和35.6%(P=0.005). ... Predicting gastric cancer response to anti-HER2 therapy or anti-HER2 combined immunotherapy based on multi-modal data 2 2024 ... 多组学数据融合分析是未来肿瘤诊疗的重要趋势.北京大学肿瘤医院沈琳教授团队收集了多中心429例HER2阳性胃癌患者的数据,包括临床信息、影像与病理学图像及其结构化报告,基于此数据集开发AI驱动的精准预测模型MuMo,该模型在抗HER2靶向治疗及联合免疫治疗反应预测中表现优异(AUC为0.821和0.914),并有效地将患者分为高风险组和低风险组,从而提供更有针对性的治疗建议[46].尽管研究展示出多组学数据与AI结合在复杂疾病中的应用前景,但肿瘤的异质性和AI算法存在的偏差,可能会影响预测的准确率.需要通过持续学习和引入更多的数据类型来进一步完善、优化模型. ...
本文的其它图/表
|